- 입력 2019.10.31 12:34
[뉴스웍스=전다윗 기자] 식품의약품안전처가 인공지능 의료기기 소프트웨어 인허가 절차를 간소화하는 등 사업자에게 부담이 되는 불합리한 규제를 개선하겠다고 31일 밝혔다. 이를 통해 미래 신성장 동력인 의료기기 분야에 힘을 싣겠다는 의도다.
이날 이낙연 국무총리 주재로 열린 국정현안점검조정회의에서 식약처는 이같이 말하며 ▲인공지능(AI) 의료기기 인허가 절차 간소화 ▲의료용 소프트웨어 임상시험자료 인정 범위 확대 ▲신개발 의료기기 제조 및 품질관리기준(GMP) 심사 간소화 등 총 8건에 대해 규제 혁신을 추진하기로 했다.
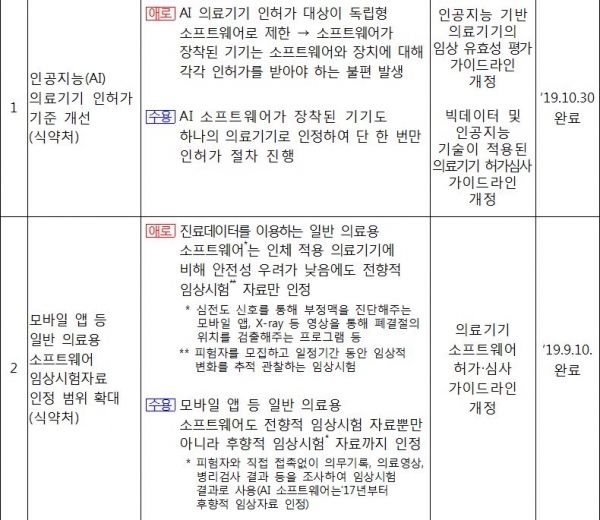
이에 따라 AI 의료기기와 기기에 속한 소프트웨어를 하나의 의료기기로 인정해 인허가 절차에 소요되는 시간과 비용을 줄이는 등 불합리한 규제를 개선한다.
또한 모바일 앱 등 일반 의료용 소프트웨어 등 후향적 임상시험 자료까지 임상시험자료로 인정해 기업이 임상시험 준비에 느끼는 부담감을 덜어줄 방침이다. 이를 통해 제품당 소요 기간은 최대 2년, 비용은 약 2억원을 절감할 것으로 식약처는 보고 있다.
아울러 현장조사를 통해 GMP 적합성을 인정받은 의료기기 제조소의 경우 현장조사를 서류심사로 대체할 수 있도록 간소화한다. 현장조사를 서류심사로 대체 시 최대 6개월 정도 심사 기간이 단축되고, 약 2000만원 상당의 준비 비용이 서류 심사 수수료 68만원으로 줄어든다.
식약처 관계자는 "앞으로도 수요자 중심의 미래 신산업 규제 혁신을 집중적으로 추진해 기업과 국민이 체감하는 가시적 규제 혁신 성과를 창출하는 데 최선을 다하겠다"고 말했다.

