- 입력 2019.12.17 19:00
송지준 KAIST 교수, 이자일 UNIST 교수 연구팀
[뉴스웍스=문병도 기자] 송지준 한국과학기술원(KAIST) 교수, 이자일 울산과학기술원(UNIST) 교수 연구팀이 암세포에서 많이 생성되고 암의 예후를 악화시키는 것으로 알려진 단백질의 구조를 규명했다.
한 사람이 가진 DNA 사슬은 실패에 감긴 실처럼 히스톤이라 불리는 단백질을 중심으로 압축되어 작은 세포의 핵 속에 들어있다.
DNA의 유전정보를 복제하거나, 유전정보를 읽어 단백질을 만드는 등 필요시에는 실패 역할을 하는 히스톤 단백질을 조절, DNA 사슬을 느슨하게 또는 팽팽하게 조절하는 역동적인 과정이 일어난다.
DNA 사슬을 조절하는 과정에서 히스톤이 뭉치거나 DNA 사슬이 엉기게 되면 유전정보의 손실이나 무분별한 유전자 발현 등이 발생하여 발생학적 질환이나 암으로 이어질 수 있다.
이러한 과정이 올바르게 작동하도록 제어하는 단백질이 히스톤 샤페론이며, 연구진은 첨단장비를 이용하여 히스톤 샤페론 중 하나인 ATAD2의 분자구조와 작용 기전을 밝혀냈다.
ATAD2는 여러 암세포에서 많이 발견되고 ATAD2가 높게 발현된 종양은 악성이 높고 환자의 예후가 좋지 않아 이 단백질을 표적으로 하는 치료제 개발 임상연구가 활발히 진행되고 있었으나, 구조나 기능에 대한 기초 정보는 거의 알려진 바 없었다.
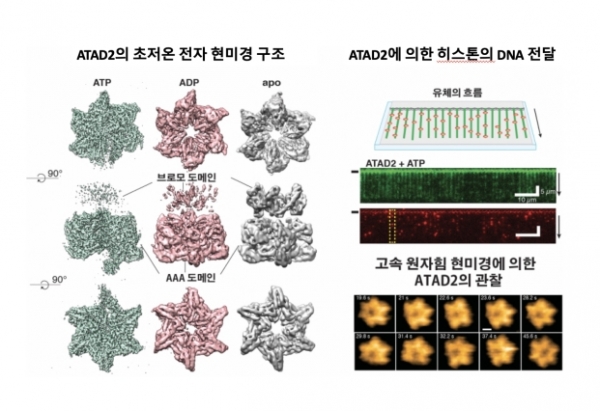
연구팀은 먼저 단백질과 같은 생체분자를 자연적인 상태대로 볼 수 있는 초저온 전자현미경을 이용해 ATAD2 단백질의 구조를 규명했다.
ATAD2가 ATP를 ADP로 분해하며 생성되는 에너지를 이용하여 나선형 구조에서 고리구조로 변형 되는 것을 알아냈다.
나아가 생체분자의 표면을 그려내는 고속원자힘현미경(AFM)을 이용해 ATAD2의 구조 변화 과정을 실시간으로 관찰했다.
고리 구조 중앙에 히스톤이 결합하며, 이 결합이 ATAD2가 히스톤을 DNA에 전달하는 데 필수적인 역할을 하는 것을 실험적으로 입증했다.
송지준 교수는 “본 연구는 초저온 전자현미경 등 첨단 생물리학적 기법을 통해 암 등의 질환과 관련된 히스톤 샤페론 단백질의 구조와 작용기전을 밝힌 것”이라며 “해당 단백질을 표적으로 하는 신약 후보 물질의 발굴을 가속화 할 것으로 기대된다”라고 밝혔다.
과학기술정보통신부 중견연구지원사업 등의 지원으로 수행된 이번 연구의 성과는 국제학술지 ‘네이처 커뮤니케이션' 17일자에 게재됐다.


