- 입력 2022.09.21 14:00
[뉴스웍스=백진호 기자] 국내 연구진이 자폐 유발 유전자인 'MYT1L'이 유년기 자폐 조기 진단 및 치료에 핵심적인 역할을 한다는 사실을 밝혀냈다.
21일 기초과학연구원(IBS)에 따르면 김은준 시냅스 뇌질환 연구단장 연구팀은 뇌과학 이미징 연구단, 배용철 경북대 치과대 교수팀과 자폐 모델 생쥐의 자폐 증상이 성장 과장에 따라 변화하는 모습을 관찰·분석했다.
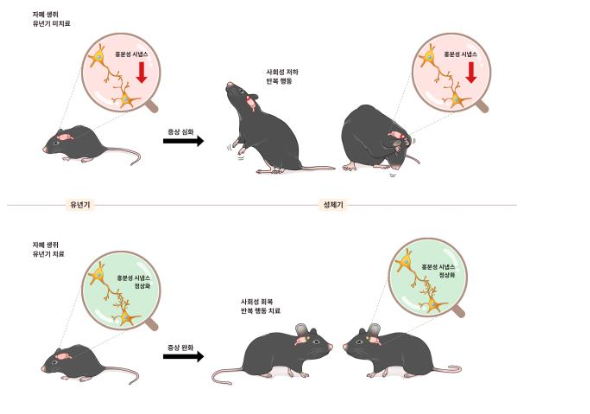
연구 결과 대표적인 자폐 유발 유전자로 알려진 'MYT1L'을 제거한 쥐가 다른 생쥐들과 어울리지 않고, 뜀박질을 반복하는 등의 자폐 증상을 보이는 현상을 포착했다.
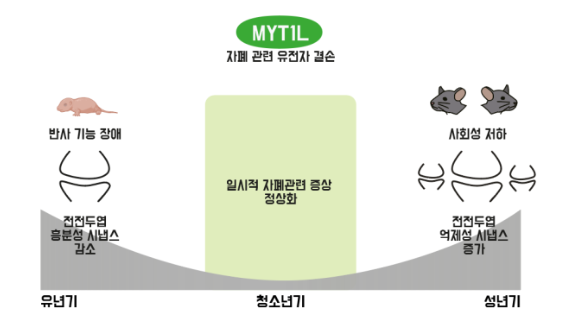
뇌는 유년기부터 변하기 시작하는데, MYT1L을 없앤 유년기 생쥐 뇌의 전전두엽에서 흥분성 시냅스의 수와 신호 전달이 현저히 감소했다. 시냅스는 흥분성 시냅스와 억제성 시냅스로 나뉘는데, 두 시냅스 사이의 균형이 깨지면 뇌 정신 질환이 일어난다.
MYT1L 결손 생쥐의 자폐 증상은 청소년기 동안 일시적으로 정상적인 모습을 보였지만, 성체 시기가 되자 다시 나타나기 시작했다. 흥분성 시냅스의 수가 감소한 유년기와 달리 MYT1L 유전자 결손이 성체 시기에 억제성 시냅스의 수와 신호 전달을 증가시켰기 때문이다. MYT1L 결손으로 발생한 유년기 뇌 변화가 오랫동안 쌓이면서 성체 시기에 이르러 다른 메커니즘을 통해 자폐 증상을 유발한다는 의미로 해석 가능하다.
연구팀은 조기 치료의 효과를 검증하기 위해 또 다른 자폐 모델 생쥐에 대한 연구를 진행했다. 연구팀은 자폐 유발 유전자 중 하나인 'ARID1B 단백질'이 없는 쥐가 사회성 저하 및 반복적 행동을 보인다는 사실을 확인했다.
ARID1B 돌연변이 생쥐의 유전자를 분석한 결과, 유년기 시절의 ARID1B 결손이 뇌 전전두엽의 흥분성 시냅스 수를 감소시켰다. 이 결과는 청소년기와 성체 시기 생쥐의 흥분성 시냅스 기능 감소를 유발했다.
연구팀은 뇌의 변화가 유년기에 시작되는 점에 착안해 실험 쥐에게 흥분성 시냅스를 촉진시키는 약물 '플루옥세틴'을 생후 3주간 투여했다. 그 결과 유년기 약물 치료를 받은 돌연변이 생쥐는 성체가 됐음에도 다른 생쥐들과 유사한 수준의 사회성·반복 행동을 보였다. 시냅스의 신호 전달과 수 역시 정상적이었다.
김은준 단장은 "연구를 통해 성장 과정에 따른 자폐 발생 메커니즘을 규명하고, 유년기의 집중 치료 후 추가로 약물을 투여하지 않아도 평생 자폐 증상을 완화할 수 있다는 사실을 확인했다"며 "다른 유전자에 의해 일어나는 자폐 증상도 유년기 조기 진단 및 약물 치료로 완화할 수 있는지 검증할 계획"이라고 밝혔다. 연구 결과는 국제 학술지 '네이처 커뮤니케이션즈' 8월 27일자 온라인 판에 게재됐다.

